重要提示:
在临床研究中,观察到口服爱谱沙期间,患者可能会出现血小板降低、白细胞减少、中性粒细胞减少、血红蛋白降低等血液学毒性,请在医生指导下使用,并在用药过程中定期进行血常规检查后调整剂量或予以对症治疗。乏力、胃肠道系统的不良反应,如腹泻、食欲下降、恶心、呕吐、消化不良、口腔溃疡也可能在服药期间发生。发热、全身水肿、呼吸道感染、皮疹、瘙痒、过敏性皮炎、低钾、低钙血症、低蛋白血症、头晕、感觉减退、背痛、关节痛、肌痛、心包积液等也在少量患者中观察得到。因此,请在专科医生指导下应用爱谱沙,并在服用爱谱沙治疗期间定期血常规检查。了解以上内容后请阅读下面的内容。

临床I期试验概况
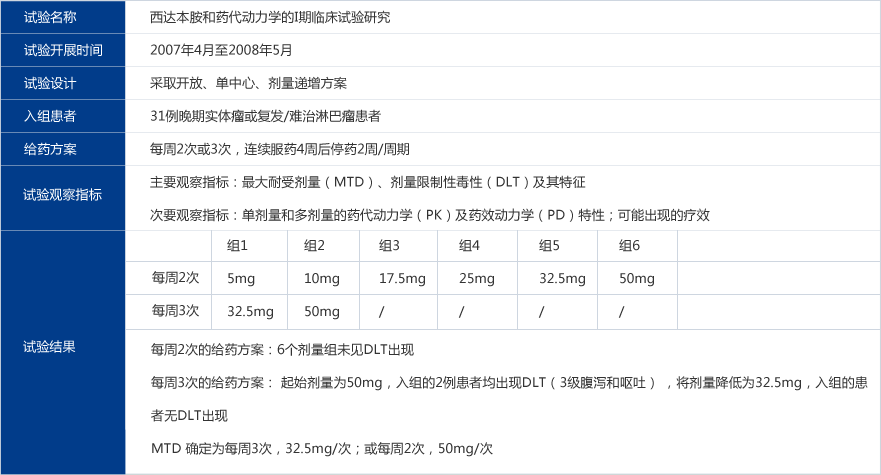
耐受性和安全性结果
一个治疗周期内的不良反应
本试验入组的31例患者在治疗的第一周期共发生75件与用药相关的不良反应。各系统发生的不良反应占所有不良反应的百分率详见下图。发生率≥10%的不良反应依次为乏力(11例患者,35%),血小板降低(8例患者,26%),厌食(8例患者,26%),白细胞或中性粒细胞降低(7例患者,23%),血红蛋白降低(6例患者,19%),恶心(5例患者,16%),腹泻(5例患者,16%),头晕(4例,13%)。
图 不良反应的严重程度分布(第一周期)
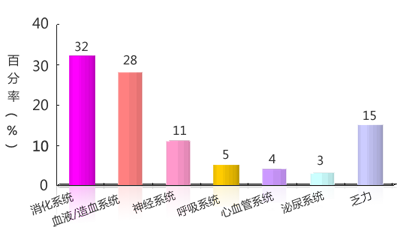
按照NCI CTCAE的标准,大多数不良反应为1级(72%),2级和3级分别为17%和11%。不良反应尤其是骨髓抑制和消化道反应的发生件数及程度大体上与剂量呈正相关。试验中未发现4级不良反应,乏力均为1级。当每周的药物暴露量达到100mg(即50mg每周两次,或32.5mg每周三次)时,出现3级血液系统不良反应;当每周的暴露量达到150mg(即50mg每周三次)时,出现3级的消化道不良反应(即DLT)。不良反应严重程度分布见图5-2。
综上,一个治疗周期不良反应的分析结果显示,西达本胺在安全剂量范围内(≤100mg/每周)的主要不良反应表现为轻度乏力和食欲下降,以及轻到中度血液毒性和轻度消化道反应。剂量限制性毒性为消化道反应。
多治疗周期的不良反应
试验中有9例病情缓解或稳定的患者接受2~6个周期的治疗,在延长治疗期间有3例患者分别出现1度心悸和气短,未见其他有临床意义的不良反应的增加,也未见到DLT报告。
剂量限制性毒性(DLT)和最大耐受剂量(MTD)
DLT
3度消化道不良反应,分别出现在每周给药3次、每次50mg组两例患者上;其他各给药方案入组患者均未观察到III度非血液毒性或IV度血液毒性。据此,I期临床试验DLT为消化道毒性。
MTD
耐受性结果显示,每周累计给药剂量≤100mg是相对安全和可耐受的,即每周2次/每次50mg或每周3次/每次32.5mg是各自给药方案下MTD。
初步疗效评价及结论
初步疗效评价
对25例基线有可测量病灶的患者,按实体瘤的RECIST标准进行了初步的疗效评价。其中获得PR 5例,SD11例,PD 9例。如表5-6所示。

a: 颌下腺腺样囊性癌
b: 肺腺癌、浸润性乳腺导管癌、肾透明细胞癌、胸腺癌、直肠腺癌、子宫内膜高分化腺癌、腺泡状软组织肉瘤、恶性平滑肌瘤、颌下腺腺样囊性癌晚期恶性肉瘤、乳腺癌、子宫内膜癌和肺癌等
初步疗效评价结果显示,淋巴瘤、特别是T细胞淋巴瘤患者对西达本胺具有明显的疗效反应。本研究共有9例难治或多次治疗后复发的晚期非霍奇金淋巴瘤(NHL)患者入组,其中T细胞型NHL 6例(可疗效评价的为5例),B细胞型3例(可疗效评价的为3例)。经一个疗程的西达本胺治疗后,有4例PR均为T细胞型NHL(3例皮肤或外周T细胞型,1例间变大细胞型NHL),2例SD均为B细胞型NHL。入组的可疗效评价的8例恶性淋巴瘤患者中,西达本胺单药治疗的客观缓解率达50%(4/8),而T细胞型NHL的客观缓解率达80%(4/5)。
同时,西达本胺对部分其它晚期实体瘤也初步显示了疗效和病情稳定作用。
结论
入组晚期实体瘤/淋巴瘤患者I期临床试验研究的综合结果显示:
西达本胺单药在不超过每周100mg的总剂量下(≤50mg/次、每周两次或≤32.5mg/次、每周三次)具有良好的安全性和耐受性,常见不良反应为轻度全身乏力、厌食和轻到中度的血液毒性。
西达本胺对淋巴瘤(特别是T细胞淋巴瘤)具有明显疗效,值得进一步试验研究探讨。
推荐后期临床试验的给药方案为:给药剂量≤50mg/次,每周2次。







