重要提示:
在临床研究中,观察到口服爱谱沙期间,患者可能会出现血小板降低、白细胞减少、中性粒细胞减少、血红蛋白降低等血液学毒性,请在医生指导下使用,并在用药过程中定期进行血常规检查后调整剂量或予以对症治疗。乏力、胃肠道系统的不良反应,如腹泻、食欲下降、恶心、呕吐、消化不良、口腔溃疡也可能在服药期间发生。发热、全身水肿、呼吸道感染、皮疹、瘙痒、过敏性皮炎、低钾、低钙血症、低蛋白血症、头晕、感觉减退、背痛、关节痛、肌痛、心包积液等也在少量患者中观察得到。因此,请在专科医生指导下应用爱谱沙,并在服用爱谱沙治疗期间定期血常规检查。了解以上内容后请阅读下面的内容。

西达本胺概述、临床定位和意义
西达本胺(Chidamide,爱谱沙®/Epidaza®)是深圳微芯生物科技有限责任公司自主研发的具有全新化学结构且获全球专利授权的亚型选择性组蛋白去乙酰化酶抑制剂,属于全新作用机制的表观遗传调控类新型靶向抗肿瘤药物,目前已经完成了以复发或难治性外周T细胞淋巴瘤为适应症的注册性临床试验研究,已于2013年3月向SFDA申报新药证书(NDA)和上市许可(MAA)。在中国多项肿瘤临床试验开展的同时,西达本胺也是我国首个获美国FDA核准在美国进行临床研究的中国化学原创新药,已完成美国I期临床试验研究。西达本胺先后获国家“十一五”863重大专项(课题编号:2006AA020603)和国家“十一五”《重大新药创制》科技重大专项等立项资助(课题编号:2009ZX09401-003),被选为科技部“十一五”国家重大科技成果之一。
复发或难治性外周T细胞淋巴瘤(PTCL)是西达本胺首个获批临床适应症,PTCL归属于罕见病范畴,目前临床上缺乏标准药物推荐治疗手段,对常规化疗反应率低,易复发,5年总生存率仅在25%左右。全球首个PTCL治疗药物Folotyn(静脉注射用药)于2009年获FDA批准上市,第二个药物Istodax(静脉注射用药)于2011年获FDA批准。新增一个新药的信息这些药物十分昂贵,且均未在中国上市。西达本胺册性临床试验结果表明,其主要疗效指标客观缓解率为28%,达到了研发的预定目标;三个月的持续缓解率为24%;用药安全性明显优于国际同类药物,且为口服用药。
西达本胺是具有完全自主知识产权中国原研创新药物,已获多国发明专利。在中国,对于复发或难治性PTCL患者开展有效药物治疗具有迫切的临床需求,西达本胺有望为PTCL患者带来新的治疗选择,延长患者生存期、改善患者生存质量。
在中国,对于复发或难治性PTCL患者开展有效治疗具有迫切的临床需求
西达本胺是具有完全自主知识产权中国原研创新药物
西达本胺(Chidamide)已获多国发明专利授权
2006年10月,微芯生物与美国HUYA公司正式签署西达本胺的国际专利授权许可和国际临床合作开发协议;美国I期临床正在开展中

西达本胺的发现-新型化学骨架带来新颖作用机制
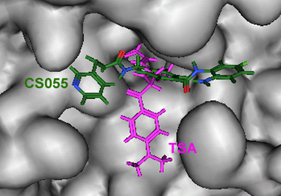
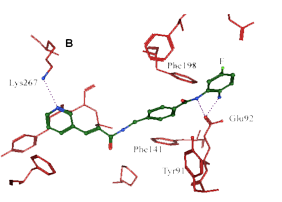
西达本胺(Chidamide,爱谱沙®,微芯生物)
(苯酰胺类,HDAC1、2、3、10选择性)
西达本胺(CS055)靶向于组蛋白去乙酰化酶(HDAC)活性区口袋上部的狭窄区域,而不是直接与催化位点上的锌原子形成螯合。而羟肟酸类(TSA)抑制剂则是直接与酶催化位点的锌原子形成螯合
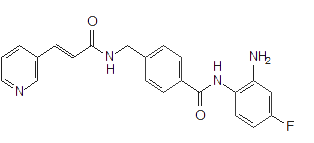
Xie EH et al.,Curr Med Chem Anticancer Agents.2004;4(3):273-99
Ning ZQ et al.,Cancer Chemother Pharmacol.,2012;69(4):901-909
Dong M et al.,Cancer Chemother Pharmacol.,2012;69(6):1413-22
Bantscheff M. et al.,Nature Biotechnology,2011;29(3):255-265
西达本胺药政及临床里程碑






