重要提示:
在临床研究中,观察到口服爱谱沙期间,患者可能会出现血小板降低、白细胞减少、中性粒细胞减少、血红蛋白降低等血液学毒性,请在医生指导下使用,并在用药过程中定期进行血常规检查后调整剂量或予以对症治疗。乏力、胃肠道系统的不良反应,如腹泻、食欲下降、恶心、呕吐、消化不良、口腔溃疡也可能在服药期间发生。发热、全身水肿、呼吸道感染、皮疹、瘙痒、过敏性皮炎、低钾、低钙血症、低蛋白血症、头晕、感觉减退、背痛、关节痛、肌痛、心包积液等也在少量患者中观察得到。因此,请在专科医生指导下应用爱谱沙,并在服用爱谱沙治疗期间定期血常规检查。了解以上内容后请阅读下面的内容。

PTCL治疗现状和尚未满足的临床需求
对于PTCL初发患者,大多采用CHOP或CHOP类似的化疗方案作为一线药物治疗。对于难治或复发PTCL患者,目前尚无标准药物治疗方案,根据2012年NCCN指南,推荐新药临床试验作为这类患者的首选治疗方法。综合而言,在所有非霍奇金淋巴瘤疾患的临床药物治疗中,PTCL患者的生存获益最为有限,5年总生存(OS)率仅为26%,具有显著的临床药物治疗需求。淋巴瘤各病种的5年生存情况,如图2-1所示。
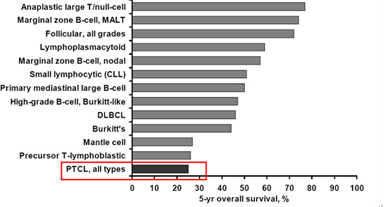
图示:外周T细胞淋巴瘤:具有显著的临床治疗需求
常规化疗
CHOP及其类似化疗方案
CHOP方案(环磷酰胺、阿霉素、长春新碱、泼尼松)或CHOP类似方案是B细胞淋巴瘤的一线标准化疗方案,也是自1993年以来作为PTCL的一线基本治疗方案。治疗后PTCL患者有约一半左右出现缓解,维持时间大约在一年左右;根据不同国家、地区的情况,5年OS率在26%(欧洲、香港等)[8]至37%(美国)。
对于难治患者或缓解后再复发的患者,更为激进的化疗方案只增加毒性,并不能提高疗效,缓解期进一步缩短,而且患者在2年内的生存率低。同时,患者对联合化疗方案的耐受性差,严重不良反应的发生率可达5~15%,这些研究结果说明,CHOP及CHOP类化疗方案并非PTCL的最佳治疗方案。
CHOP与其他药物联合方案
很多研究正在探索在CHOP方案中联合新药物以提高疗效,如加入抗CD25阿伦单抗(Alemruzumab)、地尼白介素、吉西他滨、硼替佐米、顺铂等。在CHOP联合 阿仑单抗治疗初治PTCL患者的II期临床试验中,该联合方案的客观缓解率(ORR)达到了75%,且完全缓解(CR)率为71%,但90%患者发生了4级中性粒细胞下降, 32%患者发生巨细胞病毒重新激活;类似地,CHOP联合地尼白介素针对初治PTCL的II期临床试验结果也显示,虽然联合方案的缓解率可达65%,但耐受性较差,49例患者中3例患者在第一疗程后死亡(2例为心源性、1例横纹肌溶解);而在CHOP与吉西他滨联合的临床研究中,虽然缓解率达到了77%,耐受性尚可,但中位无事件生存期仅为7个月,不能给患者带来生存期上的获益。
同时,目前在CHOP基础上进行改良的各种探索联合方案虽然较多,但缺乏多中心大样本的临床试验验证其疗效和安全性,未能得到广泛学者的公认,因此尚需进一步的大型临床试验来确证。
干细胞移植
无论是回顾性还是前瞻性研究均显示,PTCL患者在化疗后首次获得缓解之后立即进行造血干细胞移植(hematopoietic stem cell transplantation,HSCT),有利于延长患者的生存期。因此,NCCN治疗指南中指出,对于中高危PTCL患者(除ALK+间变大细胞淋巴瘤患者外),推荐患者在化疗后初次获得缓解后进行干细胞移植的一线巩固治疗。
自体干细胞移植(ASCT)
临床上大剂量化疗联合自体造血干细胞移植(autologous hematopoietic stem cell transplantation,ASCT)是骨髓未受浸润的恶性淋巴瘤的常用手段。
回顾性研究显示,采用此联合方案治疗PTCL患者时,5年的OS率为40-50%,5年的无疾病生存期(DFS)率为30-40%。Reimer P等近期报道了一项前瞻性研究,该研究共入组了83例PTCL患者。这些患者首先进行了4-6个周期的CHOP方案治疗,然后再采取dexaBEAM(强的松、卡莫司汀、美法仑、依托泊苷、阿糖胞苷)或ESHAP(依托泊苷、甲泼尼龙、阿糖胞苷、顺铂)治疗。之后对于经治疗后获得缓解的55例患者进行ASCT。随访分析结果显示,3年OS率、3年DFS率、3年的无进展生存期(PFS)率分别为48%、53%、36%。而化疗后未获得缓解的PTCL患者未接受ASCT,其预后较差,中位生存期低于2年。
异基因干细胞移植(allo-SCT)
异基因干细胞移植(allogenietic stem cell transplatation,allo-SCT)是一种潜在根治PTCL的手段。与ASCT相比,具有2点优势:①可避免回输的造血干细胞被肿瘤污染;②移植物抗宿主效应能清除宿主体内残存的瘤细胞。所以,理论上allo-SCT具有缓解率高和复发率低的特点,但allo-SCT毒性较高,治疗相关死亡率 (treatment relative motality,TRM)明显增加,因此与ASCT相比,未能给患者带来更多的生存期获益。
美国国际血液与骨髓移植中心在2010年ASH年会上公布了一项PTCL患者采用allo-SCT和ASCT治疗的研究结果。该研究共入组了241例年龄≦60岁的患者,其中115例患者采用ASCT,126例患者采用allo-SCT。结果显示,allo-SCT组与ASCT组相比,治疗后100天时的TRM分别为17% vs 2%,3年的OS率分别为37% vs 47%,3年的PFS分别为46% vs 59%(P=0.046)。多因素分析结果显示,allo-SCT组患者的疾病复发率较ASCT组明显降低(相对危险度(RR)为0.5,95%CI为0.26-0.97),但allo-SCT组患者的TRM比ASCT组明显升高(RR=3.03,95%CI为1.02-8.96),因此,allo-SCT较低的疾病复发率被较高的TRM抵消,未能体现生存期上的更多获益。
新获批上市药物
PTCL是一组异质性疾病,大多数恶性程度高、侵袭性强、预后较差,传统化疗方案CHOP等疗效欠佳,且易复发,因此,针对复发性/难治性PTCL新药研发已成为淋巴瘤领域中最具挑战性、前沿性的热点,很多新型药物正在进行不同阶段的临床试验,主要包括叶酸代谢抑制剂、组蛋白去乙酰化酶(HDAC)抑制剂、单克隆抗体和免疫毒素、核苷类抗代谢药物等。其中叶酸代谢抑制剂普拉曲沙(Pralatrexate,Folotyn)、HDAC抑制剂Romidepsin(FK228)已分别于2009年和2011年被美国FDA批准上市用于复发性/难治性PTCL的治疗。
普拉曲沙(Pralatrexate,Folotyn)
普拉曲沙(Pralatrexate)是一个抗叶酸化疗药物,由甲氨蝶呤改造而来,通过抑制二氢叶酸还原酶而达到抗肿瘤的作用,为静脉输注给药。2009年9月,美国FDA 通过快速审批程序,批准该药为治疗PTCL的罕见病孤儿新药上市,使Pralatrexate(商品名Folotyn®)成为全球范围内首个针对PTCL为适应症的上市新药。
用于新药注册申报(NDA)的入组111例PTCL患者的单臂、开放II期临床试验结果显示,在可进行疗效评价109例患者中,Pralatrexate临床缓解率(CR+PR)为26.6%。在安全性方面,试验中所有患者均出现不良反应,其中3级以上的为43%,4级以上的为31%。最常见的3级及以上的不良反应为白细胞减少(32%)、黏膜炎(21%)中性粒细胞减少(20%)和贫血(17%)。
以上数据显示,尽管Pralatrexate具有一定的适应症疗效,但安全性问题仍比较明显,从而可能会降低PTCL患者从药物治疗中的综合获益。
Romidepsin(FK228)
Romidepsin(FK228,商品名Istodax)于2010年9月被美国FDA批准作为第二个难治或复发性PTCL治疗药物上市。Romidepsin是一个环四肽类的非选择性HDAC抑 制剂,为静脉给药,其上市申请的获批主要是基于一项有131例患者参加的II期临床试验,为单臂、开放设计。Romidepsin临床缓解率(CR+PR)为25.4%.
安全性方面,与用药有关的严重不良反应发生率超过40%,常见的为发热(7%)、感染(5%)、肺炎(5%)、脓毒症(5%)。有5例患者死于感染,因不良反应退 出试验的患者比率为19%。研究数据提示,与首个上市药物Pralatrexate情况相似,尽管Romidepsin具有一定的适应症疗效,但安全性问题仍比较明显,从而可能会 降低PTCL患者从药物治疗中的综合获益。
Belinostat
2014年7月,美国FDA通过加速批准通道批准了Spectrum的HDAC抑制剂belinostat(商品名:Beleodaq)上市,治疗复发或难治性外周T细胞淋巴瘤(PTCL)。根据一项有120名复发或难治性PTCL患者参与的多中心、单臂的2期临床研究,有25.8%的患者获得缓解,其中有10.8%的患者完全缓解。常见的不良事件包括发热、贫血、恶心、呕吐和疲劳等。并有1例和用药相关的因肝功能衰竭导致的死亡事件。这也是自2009年至今FDA批准的第三个治疗PTCL药物。
未能满足的临床需求
从疾病进程和现有治疗手段上看,PTCL具有患病率低,累及人数少,属于罕见病范畴,严重缺乏综合获益良好的有效治疗药物的特征。传统的化疗治疗PTCL无法获 得满意的疗效,新近在美国批准的Pralatrexate与Romidepsin虽然可获得一定的疗效,但安全性代价较高,且药物价格高昂,远非中国患者所能承受。因此,西达 本胺为中国PTCL患者带来了有效且相对安全的新型药物治疗选择。






